|
Начало раздела Производственные, любительские Радиолюбительские Авиамодельные, ракетомодельные Полезные, занимательные |
Хитрости мастеру Электроника Физика Технологии Изобретения |
Тайны космоса Тайны Земли Тайны Океана Хитрости Карта раздела |
|
| Использование материалов сайта разрешается при условии ссылки (для сайтов - гиперссылки) | |||
|
Навигация: => |
На главную / Каталог патентов / В раздел каталога / Назад / |
|
ИЗОБРЕТЕНИЕ
Патент Российской Федерации RU2080598
![]()
СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВИРОВАННЫХ Т-ЛИМФОЦИТОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА
Имя изобретателя: Фролов Александр Кириллович[UA]; Шипитяк Евстахий Григорьевич[UA]; Негусторова Алла Федоровна[UA]; Лупинос Оксана Витальевна[UA]; Пискун Марина Николаевна[UA]
Имя патентообладателя: Запорожский государственный университет (UA)
Адрес для переписки:
Дата начала действия патента: 1992.09.03
Использование: в области медицины и касается выявления в организме человека активированных T-лимфоцитов. Сущность изобретения: проводят забор крови из пальца или вены в пробирки с антикоагулянтом, выделяют лимфоциты, полученные лимфоциты используют для постановки спонтанного розеткообразования с эритроцитами барана без холодовой инкубации ("немедленные розетки") и по количеству лимфоцитов, прикрепивших более 10 эритроцитов барана, определяют активированные. Способ позволяет повысить объективность оценки, упростить определение и сократить времена анализа функциональной активности лимфоцитов, непосредственно в организме человека.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к медицине, а именно к иммунологическим методам исследования, и касается выявления в организме человека активированных T-лимфоцитов.
Известен способ определения T-лимфоцитов в крови, включающий в себя выделение лимфоцитов, добавление к ним эритроцитов барана, инкубацию не менее одного часа при температуре 4oC, приготовление препаратов и их анализ по числу прикрепившихся эритроцитов [1] За T-лимфоциты принимают клетки, прикрепившие не менее трех эритроцитов барана. Однако данным методом можно определять только количество T-лимфоцитов, без определения их активности в организме.
Известен и способ определения активированных T-лимфоцитов в крови человека, включающий культивирование лимфоцитов 48 54 часа в питательной среде с митогеном фитогемагглютинином (ФГА), стимулирующим к пролиферации в условиях культуры преимущественно T-лимфоциты, введение колхицина, останавливающего деление лимфоцитов на стадии метафазы, приготовление препаратов хромосом и их цитогенетический анализ [2] Данный метод основан на анализе в лимфоцитах, проходящих первое митотическое деление, ассоциаций акроцентрических хромосом, являющихся цитогенетическим следом (признаком) их предшествующей пролиферации и миграции из периферических лимфоидных органов в организме человека. За активированные принимаются лимфоциты без ассоциаций и с двумя ассоциирующими акроцентриками, образовавшиеся в результате серии митотических делений, при которых разрушаются ассоциации. Данный метод является достаточно сложным (необходимо культивировать лимфоциты в стерильных условиях, останавливать деление клеток колхицином, так как хромосомы можно изучать только на стадии метафазы митоза), малодоступным для массового внедрения (необходимы дефицитные реактивы, дорогостоящее оборудование), а и требуется определенная квалификация исполнителя (значение культуры клеток, владение цитогенетическим методом). Данный метод недостаточно объективный, так как в культуре часть лимфоцитов погибает и не все из живых лимфоцитов вступают в митотический цикл на период фиксации клеток.
Целью предложенного способа является повышение объективности оценки, упрощение определения и сокращение времени анализа функциональной активности лимфоцитов непосредственно в организме человека.
Поставленная цель достигается тем, что в известном способе, включающем определение активности лимфоцитов по остаточным признакам их антигензависимой активации и пролиферации в периферических лимфоидных органах, осуществляют спонтанное розеткообразование с эритроцитами барана без холодовой инкубации ("немедленные розетки"), в препарате учитывают количество прикрепившихся эритроцитов барана к T-лимфоцитам (авидность), и по количеству T-лимфоцитов, прикрепивших более 10 эритроцитов барана, определяют активированные.
Сопоставительный анализ заявляемого решения с прототипом показывает, что заявляемый способ отличается от известного тем, что число активированных T-лимфоцитов определяют путем анализа авидности T-лимфоцитов к эритроцитам барана в мазке, приготовленном при постановке спонтанного розеткообразования с эритроцитами барана без ходовой инкубации ("немедленные розетки"). За активированные принимаются T-лимфоциты, прикрепившие более 10 эритроцитов барана. Следовательно, полученный образце лимфоцитов не надо культивировать, кроме того, объем его может быть минимальным (0,5 0,6 мл) и позволяет объективно выделить лимфоциты из цельной крови для розеточных тестов, что значительно упрощает метод и делает его доступным для скренирующих исследования. Таким образом, заявляемое решение соответствует критерию "новизна".
Известны технические решения постановки метода спонтанного розеткообразования с эритроцитами барана без холодовой инкубации ("немедленные розетки") (2, 4, 5). Однако в указанных технических решениях (3, 4, 5) не был выделен и функционально обоснован авидный класс T-лимфоцитов, прикрепивший более 10 эритроцитов барана, что не позволяло достичь поставленной цели, а именно выделить активированные T-лимфоциты в организме. Поэтому способы (3, 4, 5) постановки и анализа "немедленных розеток" являются количественными, а не качественными.
Неизвестны технические решения, в которых активность лимфоцитов в крови определяют по числу прикрепившихся к ним эритроцитов барана при немедленном способе постановки розеток. Определение активированных T-лимфоцитов розеточным тестом без их холодовой инкубации по доле высокоавидных к эритроцитам барана лимфоцитов (прикрепивших более 10 эритроцитов барана) в препарате не следует явным образом из известного уровня техники. Исходя из этого, заявляемое решение соответствует требованию "изобретательского уровня".
Предлагаемый способ осуществляют следующим образом. Проводят забор крови из пальца или вены в пробирки с антикоагулянтами, выделяют лимфоциты, доводят их концентрацию до 2,0Ч106 клеток на 1 мл питательной смеси, состоящей из среды 199 и 10% эмбриональной телячьей сыворотки, адсорбированной против эритроцитов барана и человека, инактивированной при 56oC 30 мин. Затем 0,1 мл полученной взвеси лимфоцитов смешивают с 0,1 мл 0,5% взвеси отмытых эритроцитов барана, разведенных в той же питательной среде, что и лимфоциты. Клетки инкубируют в термостате 10 мин при 37oC, центрифугируют при 200 5 мин, фиксируют розетки добавлением 0,05 мл 3% раствора глютарового альдегида (pH 7,2 7,4) в течение 20 мин при комнатной температуре, отмывают от фиксатора избытком дистиллированной воды и центрифугированием при 1000 об/мин 5 мин. Надосадочную жидкость удаляют, оставляя объем 0,1 0,2 мл, в котором клетки тщательно ресуспендируют и приготавливают мазки на обезжиренных предметных стеклах. Мазки фиксируют 5 мин в метаноле, окрашивают и микроскопируют. В препарате изучают до 400 лимфоцитов в четырех разных участках препарата. Розеткообазующие лимфоциты группируют в три авидных класса: 1 класс 3 6 прикрепившихся эритроцитов барана, 2-й класс 6 10 и 3-й класс более 10 эритроцитов барана. По доле последнего класса определяют активированные T-лимфоциты на момент взятия образца крови на анализ.
Основанием для утверждения, что субпопуляция циркулирующих лимфоцитов, присоединяющих более 10 эритроцитов барана, является субпопуляцией активированных лимфоцитов, служат данные об их определенной динамике у здоровых и больных лиц (см. таблицу), а и обнаруженная высокая (r 0,8 - 0,9) положительная корреляция этой доли лимфоцитов с частотой классов лимфоцитов без ассоциация и с двумя ассоциирующими акроцентриками. Согласно прототипу указанные цитогенетические классы лимфоцитов и являются активированными антигенами, образовавшимися в периферических лимфоидных органах после серии митотических делений при иммуногене. Высокая положительная корреляция сравниваемых показателей, полученных разными способами, свидетельствует об однородности анализируемых субпопуляций среди циркулирующих лимфоцитов. Эти субпопуляции входят в состав постпролиферативного пула лимфоцитов, вновь образующихся в периферических лимфоидных органах при иммуногенезе в ответ на имеющиеся в организме многочисленные антигены и аутоантигены. Следовательно, эти лимфоциты являются активированными. После серии митотических делений (6-10 раз), активированные субпопуляции лимфоцитов мигрируют из периферических лимфоидных органов в общую циркуляцию и становятся доступными для анализа при взятии крови. При движении хромосом ассоциации хромосом разрушаются или их остается минимальное количество, то есть они составляют класс лимфоцитов без ассоциаций и с двумя ассоциирующими акроцентриками. Кроме того, во вновь образовавшихся T-лимфоцитах сохраняется высокая плотность мембранных СД 2-антигенов. Поэтому они являются высокоавидными к эритроцитам барана и при контакте с ними присоединяют более 10 эритроцитов барана. В длительно циркулирующих (дни, недели, месяцы) интактных лимфоцитах плотность СД 2-антигенов снижается, т.к. данный стадиодиференцированный антиген принимает участие преимущественно в процессах антигеннезависимой активации лимфоцитов. Следовательно, неактивированные (временно интактные) T-лимфоциты присоединяют меньшее число (<10) эритроцитов барана.
Частота активированных лимфоцитов среди циркулирующего пула лимфоцитов зависит от интенсивности их образования в перфиерических лимфоидных органах, а и от активности и направления их миграции к антигенным патологическим очагам, что отражено в приводимой таблице.
Изучалась частота активированных лимфоцитов с помощью заявляемого способа и прототипа у следующих контингентов лиц:
- здоровые доноры 10 человек;
- онкогенные больные с экссудативным плевритом канцерозной этиологии 9 человек.
В таблице представлены результаты частоты розеткообразующих T-лифоцитов, полученных по способу с холодовой инкубацией, характеризующих общее количество T-лимфоцитов, и без холодовой инкубации "немедленные розетки", характеризующие субпопуляции T-лимифоцитов с повышенной плотностью рецепторов к эритроцитам барана (СД 2 антиген).
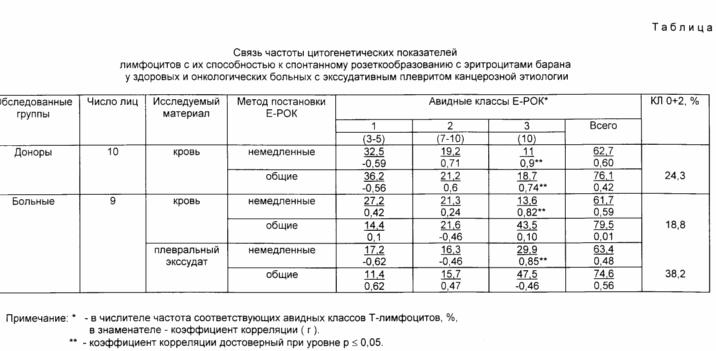
Из таблицы видно, что общая частота "немедленных розеток" во всех образцах лимфоцитов значительно меньше, чем частота общих розеток и соответствует данным литераты [3] Без холодовой инкубации успевают образовать розетки только лимфоциты с повышенной плотностью рецепторов СД 2. Анализ частоты авидных классов в крови и плевральном экссудате показывает, что только высокоавидные T-лимфоциты, относящиеся к третьему классу, при немедленном способе постановки розеток проявляют характерную для данной иммунологической ситуации динамику. Так, частота лимфоцитов, прикрепивших более 10 эритроцитов барана в плевральном экссудате в 1,5 2 и более раз превышала частоту таких лимфоцитов в крови. Подобная динамика в крови и плазме была обнаружена и для класса лимфоцитов без ассоциаций и с двумя ассоциирующими акроцентриками (КЛ 0+2).
При коррелятивном анализе частоты КЛ 0 + 2 в крови и плазме выявлено, что данный цитогенетический показатель активности T-лимфоцитов достоверно высоко (r 0,82 и 0,85 соответственно) коррелирует только с частотой T-лимфоцитов, присоединивших более 10 эритроцитов барана в постановке метода розеткообразования без холодовой инкубации.
Такие различия активированных T-лимфоцитов в цитоннетическом и розеточном тестах в крови и плевральном экссудате возникли за счет их перераспределения, то есть миграции из крови и депонирования в легких, где локализуется мощный антигенный очаг (метастазы опухоли).
В крови здоровых доноров средняя частота "немедленных розеток" и ниже общих розеток и это снижение происходило за счет доли высокоавидных T-лимфоцитов третьего класса. Кроме того, между ними и частотой КЛ 0 + 2 имелась более тесная положительная корреляция.
Полученная динамика частоты высокоавидных к эритроцитам барана T-лимфоцитов и их тесная корреляция с частотой КЛ 0 + 2 подтверждают их иммунологическую активность. Следовательно, показатель частоты T-лимфоцитов, присоединивших более 10 эритроцитов барана в тесте "немедленных розеток", является функциональным тестом активности циркулирующих T-лимфоцитов. Суммарные показатели частоты розеткообразующих лимфоцитов с холодовой и без холодовой инкубации остаются количественными тестами и достоверно не коррелируют с функциональными показателями T-лимфоцитов.
Циркулирующие в организме T-лимфоциты,
присоединившие более 10 эритроцитов барана,
имеют большую плотность соответствующих
рецепторов (СД 2-антигены), как остаточный
признак их предшествующей активации в
периферических лимфоидных органах. СД 2-антиген
участвует в межклеточных контактах,
обусловливая антигензависимую (неспецифическую)
пролиферацию и дифференцировку
комитированных лимфоцитов [6] Его
комплементарность к эритроцитам барана, а
следовательно, и связь с ними, случайна. Об
этом свидетельствуют данные об увеличении
авидности лимфоцитов (числа прикрепившихся
эритроцитов барана) в процессе их
неспецифической митогенной стимуляции
лектинами в условиях культивирования в
пробирке, уже через час после добавления
митогена (фитогемагглютинина,
конкаванавалина А, митогена лаконоса) еще в
отсутствии синтеза ДНК [7, 8]
Следовательно, увеличение плотности СД 2
антигена является ранним признаком
активации T-лимфоцитов. В периферических
лимфоидных органах лимфоциты после
антигенспецифической и
антигеннеспецифической активации
трансформируются в бластные клетки с
высокой плотностью СД2-антигена, а
следовательно, и с высокой авидностью к
эритроцитам барана. Затем такие лимфоциты
митотически делятся 6 10 раз и
дифференцируются в клон антигенреактивных
T-лимфоцитов, которые покидают лимфоидный
орган, включаясь в пул циркулирующих T-лимфоцитов.
Вновь образовавшиеся T-лимфоциты сохраняют
высокую плотность рецепторов СД 2 и
становятся доступными для анализа при
взятии образца крови. В ходе дальнейшего
онтогенеза T-лимфоцитов плотность
мембранного СД2-антигена снижается.
Таким образом, по динамике высокоавидных T-лимфоцитов, прикрепивших более 10 эритроцитов барана, определяют методом "немедленных розеток" и оперативно контролируют интенсивность пролиферации и миграции активированных T-лимфоцитов; их перераспределение в организме к местам депонирования антигенов; изучают напряженность иммунитета и его коррекцию с помощью иммунотропной терапии.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Е.Ф. Чернушенко, Л.С. Когосова, С.И. Гончарова и др. Унифицированные иммунологические методы обследования больных на стационарном и амбулаторном этапах лечения. Методические рекомендации. Киев, 1988, 18 с.
2. А.К. Фролов, В.К. Фролов. Способ определения активированных T-лимфоцитов в крови. А.с. N 1024839 C 01 33/50, 1986, прототип.
3. Г. Фримель. Иммунологические методы/ Пер. с нем. М. Медицина, 1987, 472 с.
4. А. Н. Чередеев, Д.В. Пледра, К.К. Столонго. Исследование спонтанных розеткообразующих клеток периферической крови человека. Лаб. дело, 1976, N 6, 350-354 с.
5. Ж. И. Карпова, Е.Н. Мохова, Н.И. Волков. Реакция спонтанного розеткообразования лимфоцитов, выделенных из капиллярной крови. Лаб. дело, 1984, N 7, 427-429 с.
6. Клиническая иммунология и аллергология. В 3-х томах. Т. 1. Пер. с нем. /Под ред. Йегера. 2-е изд. переработанное и дополненное. М. Медицина, 1990, 528 с.
7. Ju David, Tar Jan. Heman lymphosyte subpomilation: gigant human red Blood cell rosetfes J. Jmmand. Meth. 1977. v.15 N1. p. 67 76.
8. Richie E. Patchen M. Correlation and lymphocyte commitment achivation. Ceen. Jmnuind. N 73). 1978 v 11. N 1, p. 88 97.
ФОРМУЛА ИЗОБРЕТЕНИЯ
Способ определения активированных Т-лимфоцитов в организме человека, включающий забор крови и выделение из нее лимфоцитов, отличающийся тем, что осуществляют с полученными лимфоцитами постановку спонтанного розеткообразования с эритроцитами барана без холодовой инкубации и по количеству лимфоцитов, прикрепивших более 10 эритроцитов барана определяют активированные Т-лимфоциты в организме.
Версия для печати
Дата публикации 02.04.2007гг
Created/Updated: 25.05.2018
 |
|
